2017年6月16日,杨森宣布美国食品药品监督管理局(FDA)正式批准了该公司基于Darzalex® (daratumumab)与泊马度胺、地塞米松联合用药的免疫疗法。该疗法主要用于治疗多发性骨髓瘤。临床数据显示,Darzalex®与泊马度胺、地塞米松联用有59.2%的总缓解率。
Darzalex®是首例用于临床的CD38单克隆抗体。2015年11月获FDA批准,可单药治疗至少接受过三次既往治疗的多发性骨髓瘤(包括已使用来那度胺和蛋白酶体抑制剂或已经对其产生耐药性)。
2016年11月,用于治疗接受过一次既往治疗的多发性骨髓瘤的Darzalex与来那度胺,地塞米松或Darzalex与硼替佐米,地塞米松组合获FDA批准。2016年5月20日,获欧洲药品管理局批准在欧洲上市。
至今,大约16000名病人接受过Darzalex的治疗。
西奈山医院多发性骨髓瘤临床项目副主任Ajai Chari M.D.说道:“尽管有多种治疗手段,但是多发性骨髓瘤的复发几率和耐药性却居高不下,临床上急需新的治疗手段,此次新疗法的获批,为出现耐药复发的病人提供了全新的选择。“
杨森肿瘤研究部门的Peter F. Lebowitz, M.D.说道;“这次基于Darzalex联合疗法的获批,为急需新治疗手段的病人带来了福音,并且对后续Darzalex联合疗法的研究提供了很好的指导,我们期待Darzalex能够在未来帮助人们在癌症早期提供治疗手段。”
多发性骨髓瘤是全球发病率排名第二的血液肿瘤疾病,2015年,全球范围有488000人患此疾病,101000人死亡。在美国,该疾病正以每年十万分之六点五的速度增长,并已经影响了0.7%的人。该病平均发病年龄在61岁左右,男性患病几率大于女性,患病后不接受治疗的平均存活时间是7个月,以现有的治疗手段可延长4-5年。
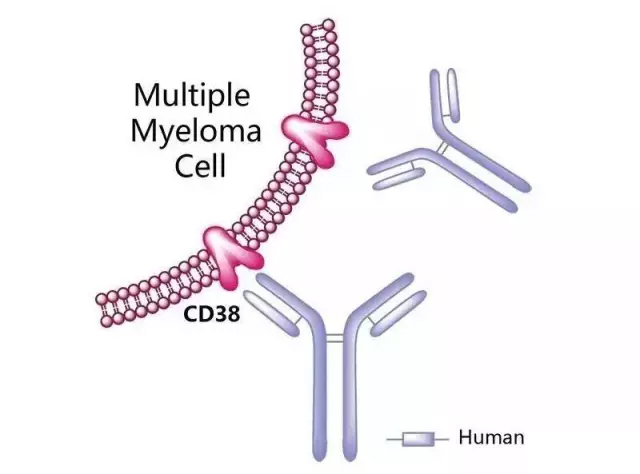
Darzalex®是用于静脉输液的首个针对CD38的单抗药物,CD38是多发性骨髓瘤在任何时期都会高度表达的细胞表面蛋白,Darzalex可以通过多种免疫介导途径诱导肿瘤细胞死亡,包括补体依赖性细胞毒性反应(CDC)、抗体依赖性细胞介导的细胞毒性(ADCC)、抗体依赖性细胞吞噬(ADCP)。数据显示,Darzalex还可以有效降低骨髓来源的抑制性细胞(Myeloid-derived suppressor cells,MDSCs),MDSCs是一种可以抑制免疫应答的细胞。
Darzalex的安全性和有效性在两项公开的研究中得到了证实,其中一项由108名受试者参与的研究中,有29%的患者完全或部分减少了肿瘤负担且平均维持时间达到4.7个月,另一项由42名受试者参加的研究中,36%的患者完全或部分缓解了肿瘤负担。
除已获批的组合疗法,还有5项基于Darzalex的组合疗法处在Ⅲ临床研究,包括对多发性骨髓瘤的前线用药研究和复发用药研究。其他研究还包括对实体瘤治疗效果的评估,或治疗表达CD38的恶性疾病。
参考:
1. DARZALEX® (daratumumab) Approved by the U.S. FDA in Combination with Pomalidomide and Dexamethasone for Patients with Multiple Myeloma Who Have Received At Least Two Prior Therapies
2. http://data.pharmacodia.com/